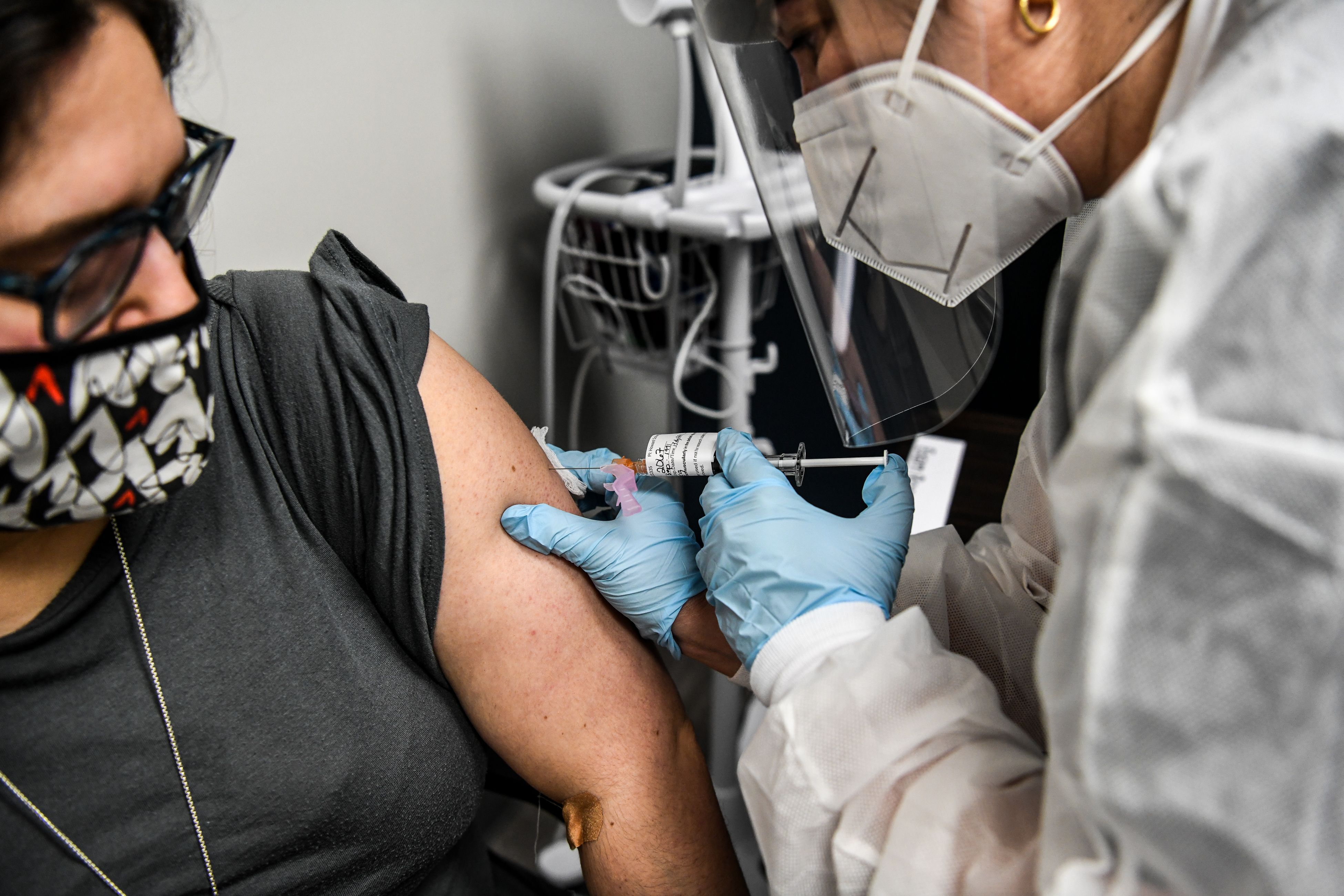
El gobierno del presidente estadounidense Donald Trump anunció esta semana que el 1 de noviembre se iniciará la distribución de una vacuna contra el Covid-19.
La declaración coincidió con el inicio de la fase 3 del proyecto de AstraZeneca, que ya desarrolla pruebas clínicas en varios países incluidos Brasil, Inglaterra, India, Sudáfrica y es probable que comience en Japón y Rusia.
Se espera que a los ensayos en Estados Unidos (EU) se inscriban alrededor de 30.000 participantes con lo que los ensayos de la vacuna de Oxford llegarían a involucrar a 50.000 participantes. Se prevé que esta prueba arroje datos para octubre, lo que abriría la posibilidad de una autorización de uso de emergencia antes de las elecciones presidenciales.
Sobre esta posibilidad, la Administración de Alimentos y Medicamentos (FDA) del país dijo que estaba abierta a otorgar autorizaciones de emergencia a vacunas candidatas, si considera que los beneficios de hacerlo superan los riesgos involucrados.
AstraZeneca aumentó su capacidad de producción de dosis tras la ampliación del acuerdo que tiene con Oxford Biomedica y se cree que responde a la posibilidad de la aprobación mencionada.
Por otra parte otro competidor líder en el desarrollo de la vacuna, el gigante farmacéutico Pfizer, también aseguró que los primeros datos de sus ensayos de fase 3 estarían disponibles en octubre.
Como se recordará las propuestas de AstraZeneca, Pfizer y Moderna cuentan con el respaldo financiero del gobierno federal de EU.
Sin embargo la Organización Mundial de la Salud (OMS) advirtió que no se debe apresurar el desarrollo de la vacuna y recomendó tener mucho cuidado al otorgar la autorización de uso de emergencia.
La advertencia se realiza cuando "un número considerable de candidatos ha entrado en la fase 3 de los ensayos” declaró la portavoz Margaret Harris quien agregó que la OMS “no espera una vacunación generalizada contra el covid-19 antes de mediados de 2021”.
Según la OMS, hay 176 proyectos de vacunas en curso en el mundo, de los cuales 34 están en fase de ensayos clínicos, lo que significa que empezaron a ser probados en seres humanos. De éstos, nueve se hallan en la fase más avanzada.
Apoyo estatal
Laboratorios europeos han pedido a sus gobiernos que compartan los riesgos financieros en caso de demandas por efectos secundarios indeseables de vacunas que se distribuyan de manera temprana.
Esta solicitud responde a que los grupos farmacéuticos esperan encontrar una vacuna en un plazo mucho menor que lo habitual, lo que impide estudiar los efectos a mediano y largo plazo, a lo que los Estados han anunciado que efectivamente podrían asumir una participación financiera por daños.
Por otra parte, como se recordará el laboratorio francés Sanofi anunció que el ensayo clínico internacional de fase 3 no había dado resultados concluyentes mientras que un estudio publicado en The New England Journal of Medicine asegura que la candidata de Novavax es segura y provoca respuesta inmune.
Por otra parte un grupo internacional de especialistas en ética de la salud criticó la estrategia Covax de la OMS de asignar a cada país vacunas contra el coronavirus para el 20% de su población, proponiendo en su lugar un esquema de asignación que consideran más justo.
El profesor estadounidense Ezekiel Emanuel, junto con 15 especialistas más de Reino Unido, Canadá, Australia y Noruega entre otros, aseguran en la revista Science que “dar la misma proporción de vacunas a cada país es una falsa buena idea y sugiere dar prioridad a los países donde la situación epidémica sea más grave”.
Primero se debe "minimizar el número de muertes prematuras", dijo y refuta la otra idea de que las dosis de vacunas deben asignarse según el número de trabajadores médicos o de personas mayores, lo que daría automáticamente ventaja a los países desarrollados.
Por otra parte un estudio preliminar sobre la vacuna rusa contra el covid-19 mostró que esta desarrolla una respuesta inmunitaria sin efectos indeseables graves, publicó The Lancet, pero aclaró que se requieren trabajos de mayor envergadura para determinar su eventual eficacia.
La publicación se basa en dos pequeños estudios conducidos entre un total de 76 adultos voluntarios, entre 18 y 60 años, en buen estado de salud. Fueron realizados entre el 18 de junio y el 3 de agosto por investigadores de los ministerios rusos de Sanidad y Defensa y financiados por el primero.
El estudio, realizado por investigadores del gobierno ruso, fue evaluado por un comité de relectura de la revista médica británica previamente a su publicación.
Las autoridades rusas anunciaron el mes pasado que su vacuna, Sputnik V, entraba a la fase definitiva, pero que no iban a esperar los resultados de esta puesto que su intención era homologarla en septiembre.
El anuncio fue acogido con escepticismo por muchos investigadores y países como Alemania y Estados Unidos, que pusieron en duda su eficacia y seguridad, debido sobre todo a la ausencia de datos públicos sobre los ensayos conducidos hasta el momento.
La OMS urgió por su parte a Rusia a seguir el protocolo establecido y cumplir "con todas las fases" necesarias para desarrollar una vacuna segura.
Moscú denunció estas críticas como una tentativa de desdeñar la investigación rusa, que según el propio presidente Putin “garantiza una ‘inmunidad duradera’ al covid-19”.
La Sputnik V consta en realidad de dos vacunas, administradas en igual número de inyecciones con un intervalo de tres semanas, según detalló el estudio publicado en The Lancet.
Se trata de una vacuna de "vector viral": utiliza dos adenovirus humanos, familia de virus muy común, responsables sobre todo de los resfriados, que son transformados para agregar el virus SARS-CoV-2, causante del covid-19.